INSTRUCCIONES PARA LA PARTICIPACIÓN EN EL CONTROL DE HPV
PROGRAMA DE CONTROL DE CALIDAD DE SEC

https://calidad.secitologia.org
PROGRAMA DE CONTROL DE CALIDAD DE SEC
Nombre:SOCIEDAD ESPAÑOLA DE CITOLOGÍA
Dirección:C/Canarias, 38
Teléfono:91 3612600 Ext. 230
Email:secretaria.citologia@kenes.com
Acreditación ISO/IEC 17043:2010: proceso de implementación entación de la norma.
COMITÉ PARA EL PROGRAMA Q-PAP DE CONTROL DE CALIDAD DE LA SOCIEDAD ESPAÑOLA CITOLOGÍA
Dra. Rosario Granados Carreño
Presidenta del Programa de Control Calidad de la SEC.
Dr. Francesc Alameda Quitllet
Coordinador del Programa de Control de Calidad de la SEC.
Dr. Antonio Martínez Lorente
Responsable del Programa de Control de Calidad de la SEC.
Dr. Francesc Tresserra Casas
Vocal del Programa de Control Calidad de la SEC.
Dra. Alejandra Caminoa-Lizarralde Aiza
Vocal del Programa de Control Calidad de la SEC.
Dra. Belén Lloveras Rubio
Presidenta de la Sociedad Española de Citología SEC.
Dr. Francesc Olivares Vegas
Secretario Técnico del Programa de Control Calidad de la SEC.
SECRETARÍA TÉCNICA DEL PROGRAMA Q-PAP DE CONTROL DE CALIDAD
Secretario Técnico:Dr. Francesc Olivares Vegas
Dirección:Hospital del Mar. Barcelona.
Teléfono:932483589
Email:calidad@secitologia.org
Programa de aptitud: PROGRAMA INTERPRETATIVO CUALITATIVO
Subtipo: PROGRAMA DE EVALUACIÓN EXTERNA DE LA CALIDAD (EQA)
Evaluación del desempeño:FASE ANALÍTICA
Producto: Programa de intercomparación para evaluar la eficacia del diagnóstico molecular en el cribado del cáncer de cérvix uterino en muestras cervico-vaginales obtenidas en base líquida.
Método de ensayo: pool de casos concentrados y homogéneos (ítems) a partir de muestras obtenidas en base líquida, con resultado previo conocido de HPV negativo y positivo alto riesgo incluyendo los genotipos de alto riesgo 16 y18, y otros, mediante pruebas de detección del ADN y pruebas de detección de ARNm E6/E7. Se pretende analizar la capacidad diagnóstica reproduciendo la práctica habitual, distanciándose de diagnósticos no usuales, (damos categoría a a los genotipos con capacidad oncogénica más frecuentes en nuestro medio) como se presupone en un programa de control de calidad de cribado.
Parámetro: Nivel de concordancia entre el valor asignado (valor de referencia) y el valor emitido (respuesta de e un participante).
Intervalo de trabajo: 1 año natural (ajustado a los distintos programas de cribado para el cáncer cervical en muestras cervico-vaginales)
Condiciones del ensayo: aquellas que se realizan en práctica habitual.
Calendario del Programa de Control de Calidad de Diagnóstico de Citología Ginecológica: q-PAP molecular 2022
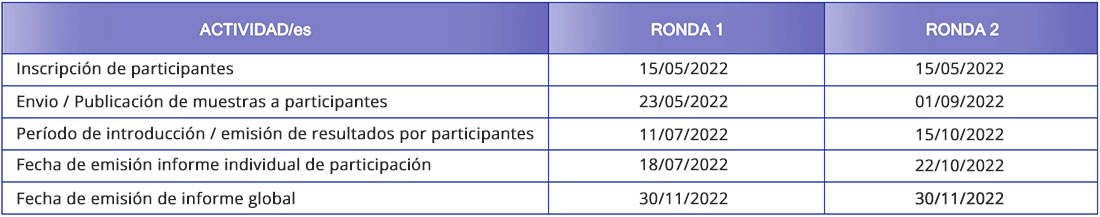
Se incluyen un total de 8 muestras provenientes de toma de citología ginecológica en medio líquido, repartidas en cada una de las rondas: 4 muestras por ronda. Las muestras están contenidas en viales de 4 μl con medio ThinPrep.
La cantidad de muestras a preparar, por pool y para cada ronda, viene determinada por la siguiente ecuación:
N+H+E+R
N: número de participantes en la ronda
H: número de muestras para homogeneidad (H=3)
E: número de muestras para estabilidad (E=2)
R: número de muestras de reserva (10% respecto del total de participantes)
Los materiales de ensayo se enviarán a los laboratorios participantes en la fecha de comienzo establecida en el programa. El envío se realiza por correo en condiciones de embalaje, almacenamiento e identificación de acuerdo a los requerimientos de IATA sin necesidad de adoptar condiciones especiales.
Las muestras se identifican como:
SEC 2022HPV_R1-R2/Caso 1_ CODIGO PARTICIPANTE
SEC 2022HPV_R1-R2/Caso 2_ CODIGO PARTICIPANTE
SEC 2022HPV_R1-R2/Caso 3_ CODIGO PARTICIPANTE
SEC 2022HPV_R1-R2/Caso 4_ CODIGO PARTICIPANTE
Donde:
El Servicio de Anatomía Patológica de Hospital del Mar(Laboratorio de Biología Molecular), actúa en el ejercicio 2022 como centro colaborador y experto. Se encuentra acreditado por UNE-EN ISO 15189 para el alcance: Detección del Virus del Papiloma Humano para genotipos de alto riesgo. . Seencargó de elaborar cuatro pool de casos, a partir de muestras obtenidas en medio líquido, con resultado previo conocido de HPV positivo alto riesgo incluyendo los genotipos 16, 18, o negativos.
La primera alícuota de cada u una de las rondas que constituyen el programa fue remitida por el Laboratorio de Biología Molecular del Hospital del Mar al Servicio de Anatomía Patológica del Hospital de Barbastro, centro que actúa como experto y se encuentra, también, acreditado por UNE-EN ISO 15189 para el alcance: Test de VPH alto riesgo - Detección molecular y genotipado (HPV 16-18).
Los resultados de ambos Servicios expertos deben ser 100% concordantes.
Se determina según instrucciones de la norma ISO/IEC 17043:2010 identificadas en los apartados:
4.4.3.4 Se debe demostrar que los ítems del ensayo de aptitud son suficientemente estables para asegurarse de que no sufrirán cambios significativos a lo largo de la realización del ensayo de aptitud, incluyendo las condiciones de almacenamiento y transporte.
4.4.3.5 Cuando se retienen para su posterior uso los ítems de ensayo de aptitud de rondas anteriores, el proveedor de ensayos de aptitud debe confirmar, antes de la distribución, los valores de la propiedad a determinar en el programa de ensayos de aptitud.
En función del número total de muestras se seleccionan para el estudio de homogeneidad y estabilidad una muestra del mismo volumen y características.
Se establece como norma la temporalidad desde la recepción de la muestra hasta la comunicación del resultado, correspondiendo a un periodo de dos meses. De este modo, se toma una muestra al inicio, una a mitad y otra al final, garantizando que el resultado sea el mismo en todos los periodos medidos.
Todos los resultados son canalizados y registrados por la Secretaría Técnica del Programa.
Valor asignado: Se determina según instrucciones de la norma ISO/IEC 17043:2010 en Anexo B apartado B.2.1(d):
"valores consensuados por participantes expertos -los expertos (que pueden, en algunos casos, ser laboratorios de referencia) deberán tener competencia demostrable en la determinación del o de los mesurados a ensayar, utilizando métodos validados conocidos por ser altamente exactos y comprobables a los métodos utilizados habitualmente".
El valor asignado para la ronda 1 del Programa 2022 quedó establecido por el Comité para el Programa q-Pap de Control de Calidad de la SEC, según consta en acta, en la reunión del día 12.03.2022.
Nivel de incertidumbre: se calcula atendiendo a las indicaciones de la ISO/IEC Guía 98-3:2008:
"Además, en muchas aplicaciones industriales y comerciales, así como en las áreas de la salud y de la seguridad, a menudo es necesario proporcionar un intervalo en torno al resultado de la medición, en el que se espera encontrar la mayor parte de valores de la distribución que pueden ser razonablemente atribuidos a la magnitud objeto de la medición. Por tanto, el método ideal para evaluar y expresar la incertidumbre de medida debería ser capaz de proporcionar fácilmente un intervalo, en particular, aquel con la probabilidad o el nivel de confianza que corresponda de manera realista con lo requerido".
Los participantes deben expresar sus diagnósticos con dos categorías:
En el apartado Observaciones, el participante puede incluir comentarios adicionales que se considere adecuado indicar.
Una vez cerrada la ronda, los participantes podrán acceder de nuevo a los casos, por si desean revisar los casos discordantes.
Los resultados enviados fuera del plazo máximo no podrán ser evaluados.
Evaluación del rendimiento: La evaluación del rendimiento se realiza mediante la relación entre dos aspectos diferentes. Por una parte la diferencia entre los resultados ofrecidos por el laboratorio frente al valor asignado considerado como verdadero, y por otra un valor de referencia o diana de incertidumbre (habitualmente expresada como desviación estándar) y que utiliza el organizador para considerar que los resultados son adecuados.
1. Coeficiente Kappa de Cohen (k), (Índice/Coeficiente Kappa): mide el grado de concordancia inter-observador y permite identificar la proporción de concordancias observadas sobre el total de observaciones, excluyendo las concordancias atribuibles al azar. El índice Kappa toma valores entre -1 y +1, teniendo presente que los resultados más próximos a +1, disponen de un grado mayor de concordancia inter-observador, mientras que el valor Kappa más próximo o igual a 0, refleja que la concordancia observada es más atribuible al azar.
Para la interpretación del coeficiente Kappa se correlaciona su valor con una escala cualitativa que incluye cinco niveles de fuerza de concordancia y permite simplificar la comprensión del mismo (pobre,débil, moderado, bueno, muy bueno).
Utilidad: compara los resultados de un participante con el resultado experto.
2. Z-Score.
Se define de acuerdo con la ecuación:
Z = (X - Xa) / p
Xa es el valor asignado por consenso (la media robusta de los resultados remitidos por los laboratorios)
p es la desviación estándar diana o adecuada al fin pretendido
X es la medida del laboratorio participante
Utilidad: compara los resultados de un participante con los resultados del resto de participantes del ejercicio.
Resultados del ejercicio
Confidencialidad y certificación de calidad de protección de datos
Toda la información relativa a los participantes inscritos en el Programa de Control de Calidad de Citología Ginecológica de la SEC será tratada con total confidencialidad, incluyendo la evaluación obtenida y no se revelará a terceras partes salvo autorización explícita del participante para un fin concreto.
En los diferentes informes, la identificación de los participantes permanecerá anónima, a través del código de identificación. Este código varía anualmente y es proporcionado por el proveedor del ejercicio, que garantizará su trazabilidad y confidencialidad.
La Sociedad Española de Citología (SEC) se compromete a mantener durante todo el programa de intercomparación los requisitos de la norma UNE-EN ISO/IEC 17043:2010. Del mismo modo, la SEC se compromete a respetar los principios éticos básicos en relación a las muestras biológicas utilizadas, siempre provenientes de imágenes de diagnósticos ya emitidos e incorporados en las historias clínicas de las pacientes, así como las normas establecidas por la Ley Orgánica 3/2018, del 5 de diciembre, de Protección de Datos Personales y de Garantía de los Derechos Digitales, que adapta la legislación española al Reglamento General de Protección de Datos de la Unión Europea (RGPD), en relación a los participantes e instituciones que forman parte del programa.
Incluirá
Se recuerda a los participantes que los materiales remitidos por el Programa de Control de Calidad de SEC, en este caso imágenes digitalizadas, deben tratarse de la misma forma que el resto de las muestras habituales procesadas en el laboratorio.
El Programa de Control de Calidad de SEC dispone de acuerdos con otros colaboradores (subcontrataciones), para garantizar el completo y eficaz desarrollo de los controles.
En caso de no estar conforme con los resultados emitidos, puede contactar con calidad@secitologia.org
¡GRACIAS POR SU PARTICIPACIÓN!
Rosario Granados Carreño
Presidenta del Programa de Control Calidad de la Sociedad Española de Citología, SEC.
26/03/19
Francesc Alameda Quillet
Coordinador del Programa de Control de Calidad de la Sociedad Española de Citología, SEC.
26/03/19
Antonio Martínez Lorente
Responsable del Programa de Control de Calidad de la Sociedad Española de Citología, SEC.
26/03/19
Francesc Olivares Vegas
Secretario Técnico del Programa de Control Calidad de la Sociedad Española de Citología, SEC.
26/03/19
Francesc Tresserra Casas
Vocal del Programa de Control Calidad de la Sociedad Española de Citología, SEC.
26/03/19
Alejandra Caminoa-Lizarralde Aiza
Vocal del Programa de Control Calidad de la Sociedad Española de Citología, SEC.
26/03/19
Belén Lloveras Rubio
Vocal del Programa de Control Calidad de la Sociedad Española de Citología, SEC.
26/03/19
UNE-EN ISO 15189: 2013.

